
HLB의 리보세라닙 FDA 승인 불발은 분명히 아쉬운 소식이지만, 이는 리보세라닙 자체에 대한 문제는 아니었습니다. FDA의 보완요구서한 이슈와 FDA의 지적사항을 해결하고, 보완 서류를 제출하여 신약 허가를 재신청 계획까지 알아보겠습니다.
목차
1. HLB 리보세라닙 소개
HLB가 개발 중인 리보세라닙은 다중표적 티로신키나아제 억제제로, 주로 간암의 치료제로 개발되고 있습니다. 이 약물은 특정 유전자 변이를 가진 환자들에게 특히 효과적일 것으로 기대됩니다. 리보세라닙은 현재 다양한 임상 연구 단계를 거쳐 진행 중이며, 특히 항서제약과의 병용요법으로도 주목받고 있습니다.
2. FDA의 보완요구서한(CRL) 이슈
FDA는 리보세라닙과 캄렐리주맙 병용요법에 대한 신약 허가 신청을 보류한 주된 이유로 캄렐리주맙의 제조공정(CMC) 문제를 지적했습니다. 캄렐리주맙은 생산현장에서 발생한 결함으로 인해 FDA의 추가 평가가 필요하다고 판단한 것입니다. 이로 인해 HLB와 항서제약은 보완 서류를 제출하고 해당 문제를 해결해야 했습니다.
캄렐리주맙의 CMC 문제 해결이 보류 사유였지만, 리보세라닙 자체에 대한 지적사항은 발생하지 않았습니다. 이는 두 약물의 병용요법 허가가 불발된 주된 이유로 작용했습니다.
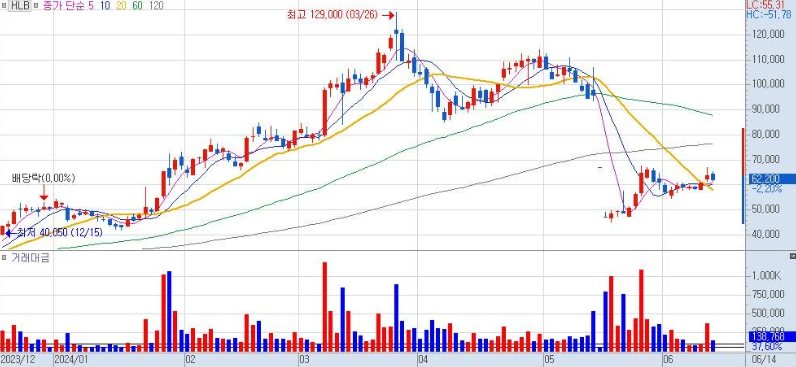
FDA신약 승인 실패후 최고 129000원까지 올랐던주가가 4만원 중반대까지 빠졌었습니다. 향후 기대감을 안고 하방지지를 만들어 내고 있는 모습입니다.
3. 향후 계획과 신약 재도전
현재 HLB와 항서제약은 FDA의 지적사항을 해결하고, 보완 서류를 재제출하여 리보세라닙과 캄렐리주맙 병용요법의 신약 허가를 재도전할 계획입니다. 이 과정에서 캄렐리주맙의 CMC 문제를 완전히 해결하고, 추가적인 임상 연구와 생물학적 연구 모니터링(BIMO)을 진행할 예정입니다. 또한, 리보세라닙은 다른 적응증에서도 글로벌 임상 3상을 빠르게 진행하여 향후 전 세계적인 허가를 목표로 하고 있습니다.
HLB의 리보세라닙은 간암 치료제로서의 효능을 입증하고 있으며, FDA 승인을 위해 캄렐리주맙과의 병용요법에서의 문제를 해결하려는 노력을 기울이고 있습니다. 두 회사는 현재 FDA의 지적사항을 해결하기 위해 적극적으로 노력하고 있으며, 향후 신약 허가 재신청을 위한 준비를 진행 중에 있습니다. 리보세라닙의 글로벌 임상 3상 진행도 예정되어 있어, 앞으로의 발전이 기대됩니다.
이처럼, HLB와 항서제약의 신약 개발 과정은 매우 도전적이지만, 긍정적인 전망을 보여주고 있습니다.
'주식' 카테고리의 다른 글
| 장전 주요 뉴스 (2024년 6월 18일) (1) | 2024.06.18 |
|---|---|
| 오늘의 특징주 상한가 24년 6월 17일 (0) | 2024.06.17 |
| 오늘의 특징주 상한가 24년6월14일 (1) | 2024.06.15 |

